Genetik
1 Erbinformation
Die gesamte Erbinformation ist in jeder einzelnen (Tier/Pflanzen-)Zelle, genauer im Zellkern, enthalten.
1 Zellteilung
1.1 Formen des Wachstums
- Zellteilung (Mutterzelle teilt sich in zwei gleiche Tochterzellen)
- Plasmawachstum (Zelle nimmt geringfügig zu --> organische Stoffe werden aufgenommen --> Plasma nimmt zu)
- Streckungswachstum (Zelle streckt sich durch Aufnahme von Wasser).
1.2 Historisches (Info)
vgl. AB
- Details
- Geschrieben von: Wolfram Hölzel
3 Formen des Wachstums
- Zellteilung (Mutterzelle teilt sich in zwei gleiche Tochterzellen)
- Plasmawachstum (Zelle nimmt geringfügig zu --> organische Stoffe werden aufgenommen --> Plasma nimmt zu)
- Streckungswachstum (Zelle streckt sich durch Aufnahme von Wasser).
3.1 Der Zellzyklus
= Entwicklungszyklus einer Zelle von der Teilung der Vorgängerzelle bis zur eigenen Zweiteilung:
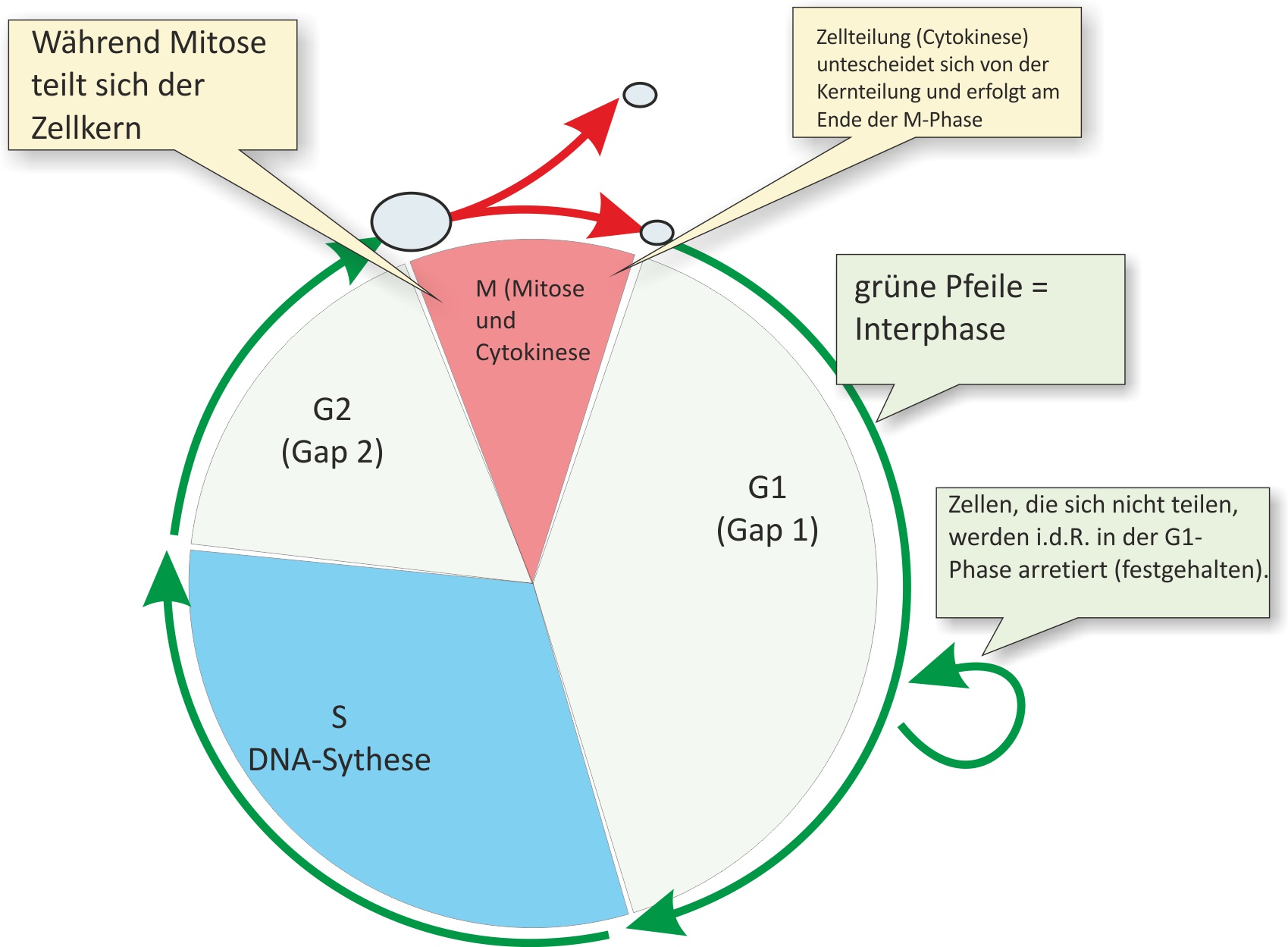
1. Wachstumsphase = Interphase
- G1-Phase
- S-Phase
- G2-Phase
2. Teilungsphase = M-Phase
- Mitose = Kernteilung
- Cytokinese = Teilung des Cytoplasmas
Funktionen der Zellteilung:
- Vermehrung
- Wachstum
- Regeneration, Wundheilung
- Details
- Geschrieben von: Wolfram Hölzel
2 Chromosom
Die Erbinformation ist auf sehr langen Molekülen gepeichert = DNA (desoxyribonucleic acid = Desoxyribonucleinsäure).
Chromosom = verpackte Form der Erbsubstanz aus DNA + Verpackungsprotein
Oder in kurz: Chromosom = DNA + Verpackungsproteine
Autosomen = Chromosomen, die keine Gonosomen sind.
Gonosomen = Geschlechtschromosomen
- Frauen: XX - Gonosomen
- Mann: XY - Gonosomen
- Details
- Geschrieben von: Wolfram Hölzel
3.1.1 Mitose
WH: Zellkern:
Der Zellkern ist die genetische Steuerzentrale der Zellaktivität
Der Zellkern (= Nucleus) enthält die DNA und ist damit die Steuerzentrale der Zelle.
Kernhülle (Aus Doppelmembran): Abgrenzung zum Cytoplasma
Kernporen: Verbindung zwischen innen und außen (mehrere Tausend)
Kernporenkomplex: Kontrolliert Ein- und Ausschleußen von Makromolekülen
Im Kern: DNA ist auf einer Reihe von Chromosomen verteilt (beim Menschen 46 Chromosomen)
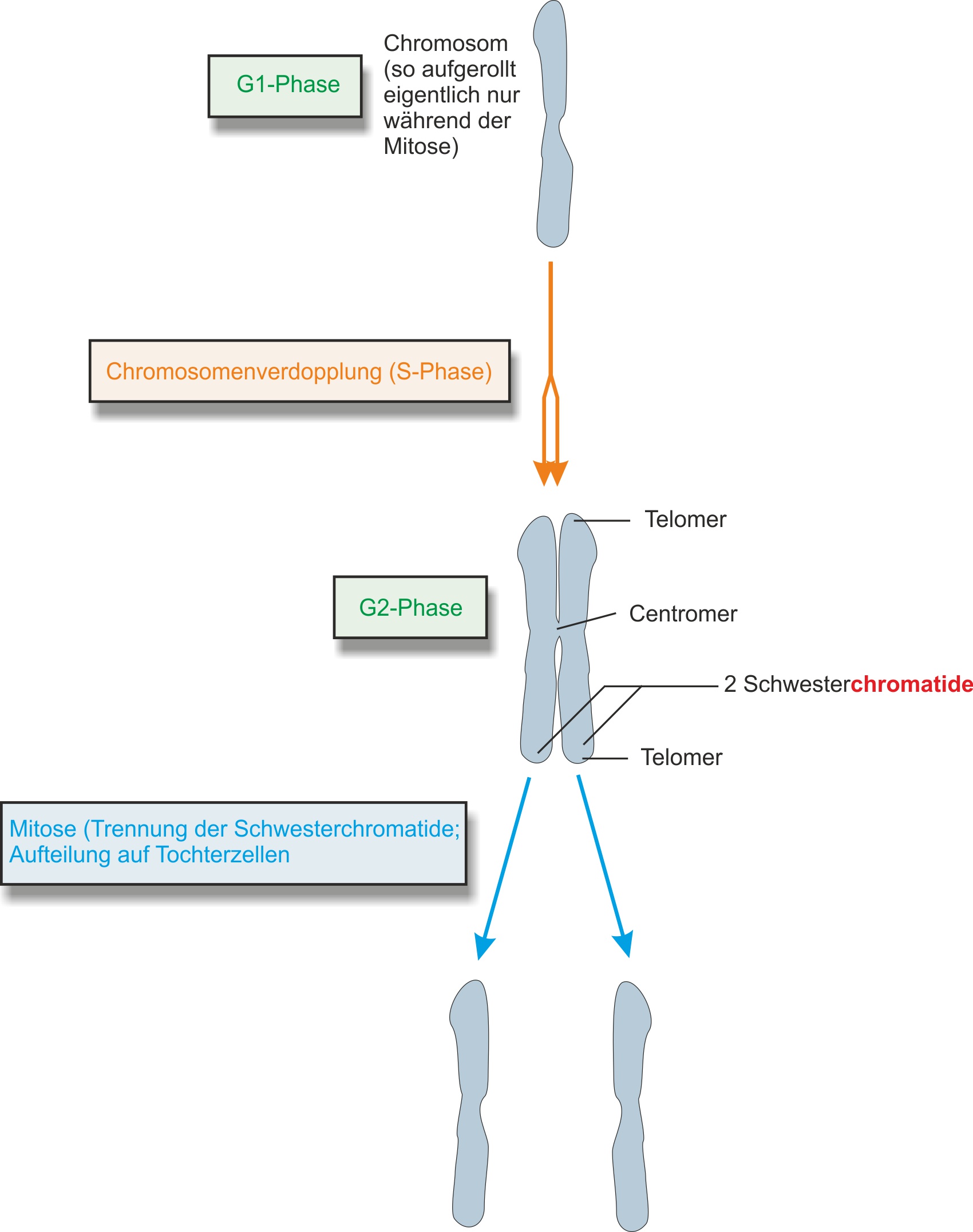
Chromatin: aufgewickelte DNA und Eiweiß. Nach der Verdopplung „kondensiert“ das Chromatin (faltet sich dicht zusammen und verkürzt sich) => Transportform, die geschützt ist (z.B. vor dem zerreißen)
Helle Bereich im Zellkern: Euchromatin --> DNA ist aktiv
Dunkler Bereich: Heterochromatin --> DNA ruht
Nucleus: Ort der Bildung von Ribosomen
a) von der S-Phase (Verdopplung) bis zur M-Phase
(Teilung in Schwesterchromatide) - eine Übersicht
b) Gesamtablauf der Mitose
Centrosomen („Zentralkörperchen“) bestimmen Ebene der Zellteilung
- Verdoppelt der Chromosome sich in der S-Phase (2. Phase der Interphase
- G2-Phase → M-Phase: Centrosomen trennen sich und wandern zu den beiden entgegen gesetzten Enden der Kernhüllen
- Startet Bildung der Mikrotubuli ⇨ Spindelstruktur (Cytoskelett)
- Pol-Mikrotubuli: Stabilisierung mit anderem Pol
- Kinetochor-Mikrotubuli: Centrosom – Kinetochor
- Astral-Mikrotubuli: Positionieren Spindel i.d.Zelle
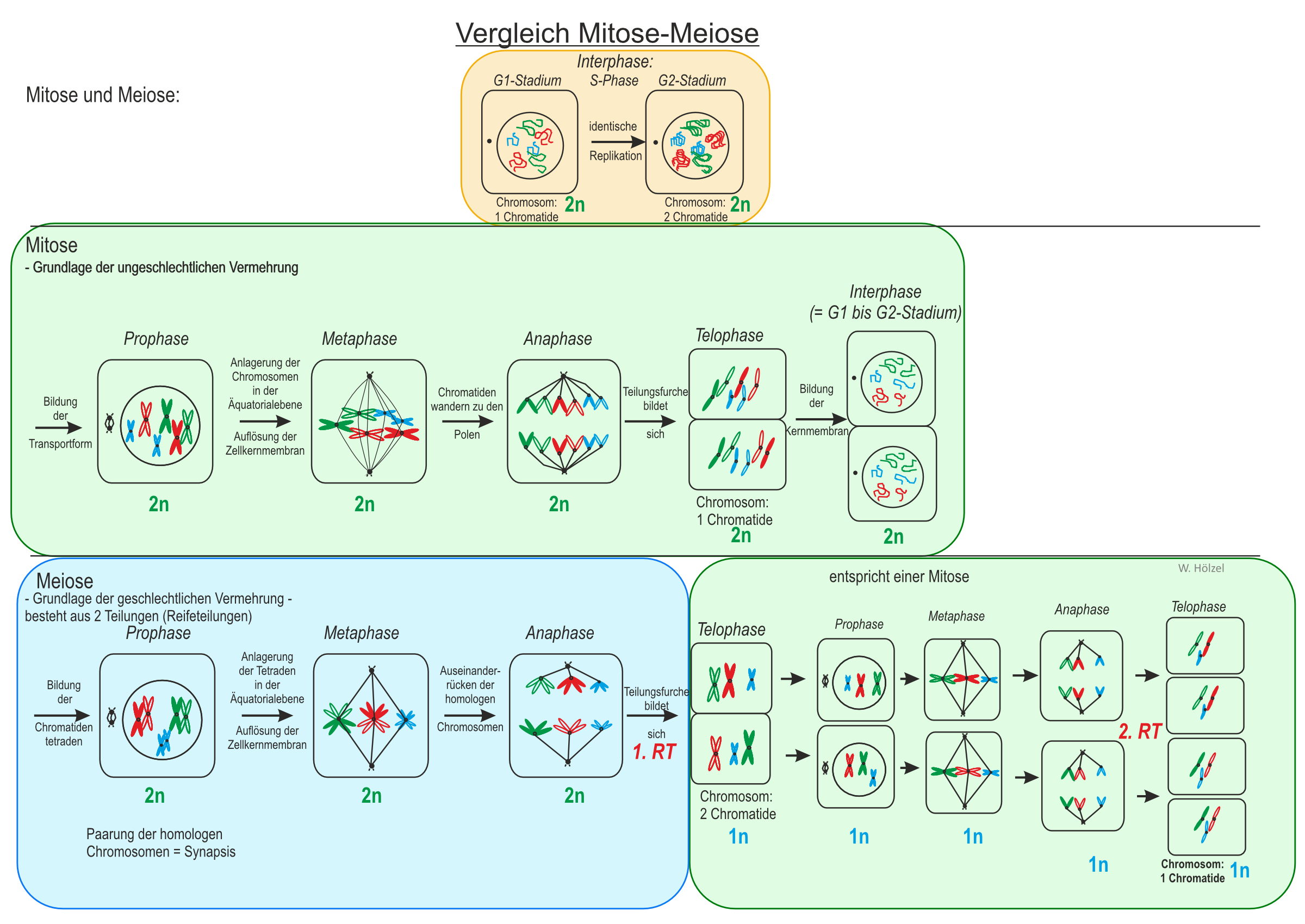
Folgende Abbildung gibt neben der Mitose auch gleich die Meiose schematisch wieder:
I. Prophase
- Chromatide werden sichtbar (Transportform)
- Mitosespindel bildet sich
- Kinetochor (Protein + DNA) bildet sich auf jedem Schwesterchromatid i.d. Centromerregion
II. Prometaphase
- Kernhülle löst sich auf
- Kinetochor-Mikrotubuli erscheinen
- Abstoßende Kraft bringt Chromosomen in die „Mitte“ = Äquatorialplatte
III. Metaphase
- Chromosomen ordnen sich mit Centromer in der Äquatoiralplatte an.
IV. Anaphase
- Schwesterchromatide trennen sich
V. Telophase
- Kernhülle + Nucleoli bilden sich neu
⇨ Cytokinese → Zellteilung
- Details
- Geschrieben von: Wolfram Hölzel
3.1.2 Die Meiose
Im folgenden nochmals der schematische Verlauf der Meiose im Vergleich zur Mitose:
Unterschiede zur Mitose:
- Es gibt zwei Teilungen (zweite ähnelt der Mitose)
- Homologe Chromosomen werden geteilt (Reifeteilung I)
- Aus einem diploiden Chromosomensatz (2n) entsteht ein haploider Chromosomensatz (1n) (Reifeteilung I)
- Die Chromosomensätze der Tochterzellen sind NICHT mehr identisch zur Mutterzelle
Wichtige Phase: Tetradenbildung = 2 homologe 2-Chromatiden-Chromosomen lagern sich parallel an.
- Details
- Geschrieben von: Wolfram Hölzel